Annual Report 2007より
宮園 浩平
ロマンチックな科学者たち
今年のAnnual Reportは趣向をかえてTGF-βの細胞外での作用について紹介したいと思います。私たちの研究室では細胞内のシグナル伝達の研究が中心ですので、皆さんはなかなか論文を読む機会がないかもしれませんが、時間があったらDaniel Rifkinのreview (The TGF-β FamilyのChapter 7)をこの機会にぜひ読んでください。
潜在型TGF-βについて
私がTGF-βの研究ではじめて論文を発表したのは1988年なので、今年はちょうど20年目の節目の年にあたります。私の学位論文になった研究で、潜在型TGF-βを血小板から純化精製し、構造を決めるというものでした。TGF-β1のcDNAをRik Derynckがクローニングしたのが1985年でしたが、その当初からTGF-βは活性を持たない潜在型として産生されるので、その活性化のメカニズムを明らかにすることが大事だ、ということが学会に行くたびに話題になっていました。私はスエーデンに留学していて、血小板を大量に使うことができたのでここから潜在型TGF-βを純化しようということになったわけです。
TGF-β1は390個のアミノ酸からなる前駆体として作られ、C末端側の112個のアミノ酸からなる部分がダイマーを作って活性を持ったTGF-βとなります。1987年に米国のベンチャーのOncogen社のグループからTGF-βのcDNAをCHO細胞に発現させると前駆体のN末端側の部分がダイマーを作り、この部分がC末端側から切断されたあとも非共有結合で結合し、TGF-βを潜在型としているということが報告されました。このため、TGF-βのN末端側の部分はLAP (latency-associated peptide)と呼ばれるようになります。TGF-βが刀にあたるとすると、LAPは刀の鞘(さや)にあたります。当時私は、TGF-βは活性が強くて危ないので普通は鞘の中に収まっていて、作用を発揮するには鞘から刀を抜き出さなければいけないのだと例えていました。ちなみに33種類存在するほ乳類のTGF-βファミリーのうち潜在型として作られることがわかっているのはTGF-β1、β2、β3のほかはmyostatinだけです。activinやBMPは潜在型として作られません。しかし面白いのはactivinやBMPは細胞外で結合してその作用を中和するタンパク質(follistatinやnoggin、chordinなど)が数多く知られていることで、TGF-βとそれ以外の因子の細胞外での作用は全く異なったメカニズムで調節されていることになります。
私は比較的容易に潜在型TGF-β1を血小板から純化したのですが、血小板から純化した潜在型TGF-βはTGF-βとLAPに加えて、LAPにS-S結合でもう一つの新たなタンパク質が結合していることが明らかとなりました。このタンパク質は210 kDaの巨大なタンパク質で、後にLTBP-1 (latent TGF-β binding protein-1)と呼ばれるようになります。血小板から得られた潜在型TGF-βはLTBP-1が結合していて分子量が大きいことからLLC (large latent complex)と、一方でCHO細胞などに発現させた潜在型TGF-βはLTBP-1を欠いているのでSLC (small latent complex)と呼ぶようになりました。
さらにLTBP-1のアミノ酸配列を決定したところ、EGF様の構造と8個のシステイン残基を含む特徴的な構造(8-Cysドメインと名付られけました)が繰り返し出てくる特徴的な構造を持つことがわかりました。この辺りはスエーデンでアミノ酸配列の決定をやり始めていたUlf Hellmanがかかりきりになって協力してくれました。これらをまとめてJBCに1988年に報告し、その後スエーデンのグループが1990年にcDNAのクローニングに成功しました(Kanzaki et al. Cell 1990)。しかし、すでにTGF-βが潜在型であるためにはLAPがもっとも重要であることがわかっており、LTBP-1はいったい何をしているのだろうということでその機能の解明がその後の大きなテーマとなりました。当時の私自身の実験で、潜在型TGF-βはLTBP-1が結合していると産生された細胞の外にスムーズに放出されますがLTBP-1が結合していないと極めてゆっくり放出されるということは分かっていましたが(Miyazono et al. EMBO J. 1991)、それ以外にも重要な機能があるのではないかと注目していたわけです。幸い私たちはLTBP-1のポリクローナル抗体をすでに作製していたのでLTBP-1の機能を調べるには極めて有利な状況にありました。しかし、そのころ私たちのグループはTGF-βのレセプターのcDNAのクローニングに着手していた時期で、グループの研究の比重は大きくレセプターのクローニングに移っていました。
ちょうどその頃、New York UniversityのRifkinから共同研究の申し入れがありました。
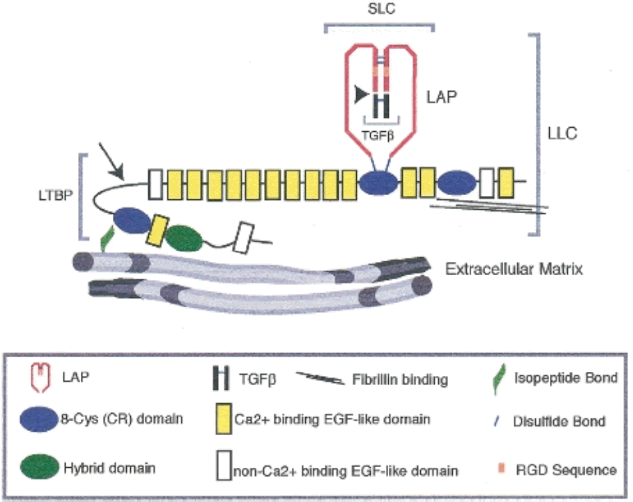
図 潜在型TGF-β(LLC)の構造の模式図
(The TGF-β Family, p.180, Cold Spring Harbor Laboratory Press, 2008より)
これは私たちにとっては重大な決断でしたが、機能の分からない分子なので共同研究に活路を見出して行こうということになりました。Rifkinの研究室に留学していた佐藤靖史先生(今はVasohibinの研究で有名ですが)が、血管内皮細胞(EC)のmigration assayを行う際にpericyteがコンタミしているとECのmigrationが抑制されることを見いだしていました。そして、そのメカニズムとして、ECやpericyteは潜在型TGF-βを大量に作っているが、ECとpericyteが混在するときだけ潜在型TGF-βが活性化されてECのmigrationが抑えられるということを報告していました。Rifkinの研究室では私が送ったLTBP-1の抗体をこの系に加えるとECのmigrationの抑制が解除されることを見いだし、ECとpericyteの混在する系では潜在型TGF-βの活性化にLTBP-1が重要であることを初めて明らかにしました(Flaumenhaft et al. JCB 1993)。
この頃、Marfan症候群の原因遺伝子fibrillinがクローニングされ(1991年)、その構造がLTBPと同様にEGF様構造と8-Cysドメインの繰り返しからなることがわかりました。このことに注目したフィンランドのKeski-OjaはLTBP-1が細胞外マトリクスと結合することを発見しました(Taipale et al. JCB 1994)。さらにテキサスのBonewaldは、LTBP-1はfibrillinと同様にmicrofibrilの構成成分であると予想し、骨の培養系でLTBP-1は細胞外マトリクスに沈着し、ECMの構成成分として機能することを明らかにしました(Dallas et al. JCB 1995)。さらに中島裕司博士ら(当時、埼玉医大)はマウスの心内膜床の分化の系ではTGF-βが内皮細胞を間葉細胞に分化させること(この頃は気づいていませんでしたが、まさにEMT研究のはしりです)、LTBP-1の抗体を加えると分化が抑えられることを明らかにしました(Nakajima et al. JCB 1997)。これらを総合すると潜在型TGF-βはLTBP-1が結合していると細胞外マトリクスに蓄積し、そこで何らかの刺激によって活性化されることになります。こうして見るとLTBP-1はTGF-βの機能に決して無視できない作用を持っているということになります。しかしLTBP-1は巨大な分子であることもあって、その分子レベルでの機能はなかなか明らかになりませんでした。
その後、LTBP-1に類似した構造を持つタンパク質が3つ見つかり、LTBP-2、-3、-4と名付けられました。このうちTGF-β1と潜在型複合体を形成できるのはLTBP-1以外ではLTBP-3と-4だけでした。そしてLTBP-3のノックアウトマウスは骨の異常や肺気腫を発症すること、LTBP-4のhypomorphic mouseでは肺気腫に加えて大腸がんができることがわかり、LTBP-3-/- mouseではリン酸化Smad2の組織レベルでの発現が低下していることからTGF-βの作用が低下していることが示唆され、TGF-βとの関連がますます注目されるようになりました。
さらに1999年ころになってLTBPの潜在型TGF-βの活性化における役割が個体レベルで明らかとなってきました。この頃になると私はLTBP研究については完全に傍観者となりましたが、この分野の研究はたいへん面白いので少しまとめてみます。試験管内では潜在型TGF-βは強酸、強アルカリ、熱処理、プラスミンなどの酵素処理によって活性化されます。LAPが切断されたり、3次元構造が変わったりすると活性化が起こるわけです。またThrombospondin-1はLAPと競合して潜在型TGF-βを活性化することも報告されました。しかしこれらの実験ではLTBPが活性化に重要であるということを証明できていませんでした。もっとも興味ある仮説は、MungerらやRifkinらによって提唱されたもので、1) TGF-β1やTGF-β3のLAPがArg-Gly-Aspというアミノ酸配列(RGD配列)を介してインテグリン(とくにαvβ6 integrin)に結合する(TGF-β2にはRGD配列がありません)、2) 一方、LTBP-1はN末端に近いhinge領域を介してECM(fibronectinが重要と言われています)に結合する、そして3) 何らかの機械的な力でLLCがECM側とインテグリン側に引っ張られると全体の構造にゆがみが生じ、その結果、潜在型TGF-βが活性化されるというものです。「機械的な力」で活性化されるというのはなかなか理解しにくいですが、炎症などで組織のリモデリングが起こった場合などを想定しています。また3') 機械的な力だけでなくMT1-MMPなどのプロテアーゼの関与も考えられています。そして、β6 integrinのノックアウトマウスや、LAPのRGD配列に変異を加えたマウスが、TGF-β1のノックアウトマウスの表現型と類似している点は少なくともLAPとインテグリンの関係の重要性を示しており、この仮説を支持していると思われます。
さて、LTBPの研究をしているときの私たちの目標はLTBPの抗体を使って潜在型TGF-βの活性化を抑えることによって線維症の治療を行なおうというものでした。しかしTGF-βの抗体やレセプターの抗体の方がよりダイレクトにTGF-βのシグナルを抑えるのではないかということでこのアイデアは休眠となりました。しかし、LTBPの作用を見るともしかするとよい治療戦略となるかもしれません。今後の発展に期待しましょう。
2007年度について
2007年度はグローバルCOEがスタートし、大学院生の研究に対しいろいろな方面からの支援ができるようになりました。リトリートなどの会合も増えましたのでやや忙しくなったかもしれませんが、有意義に活用していただきたいと思います。また今年度は癌学会などで口頭発表の機会が増え、英語で発表するチャンスも増えました。2月のKeystone symposiumでは古室さんと生島さんの発表がoralに選ばれ、私としてはたいへん名誉なことでした。こうした機会を有意義に活用して、外国の研究者とも活発にdiscussionしてもらえればと思います。今年度は論文も順調に発表することができました(現状に決して満足してはいけませんが)。いずれも私個人としては気に入っている論文です。2008年度は札幌がんセミナーなどの行事もありますが、稔り多い1年となることを期待しています。
平成20年4月 宮園 浩平
