- HOME
- 研究の内容
当研究室の研究の内容について
当研究室はがんを中心に病気の原因を明らかにし、新たな治療法を見いだすために研究を行うことを目的としています。教室では現在、宮園浩平教授、鯉沼代造准教授ほか、約20人の研究者、大学院生が研究・教育を行っています。
TGF-β(transforming growth factor-beta)は、1980年代初頭に軟寒天培地の中で正常線維芽細胞の形質転換を促進する因子として発見されました。しかし1985年にはTGF-βが上皮細胞など多くの細胞の増殖を抑制することが明らかとなり、TGF-βは腫瘍抑制因子として大きな注目を浴びるようになりました。一方で、1990年代半ばになってTGF-βが上皮細胞の間葉系細胞への分化(epithelial-mesenchymal transition、EMT)を促進することが報告され、進行したがんではTGF-βが腫瘍促進因子として働くことが明らかとなっています(下図)。
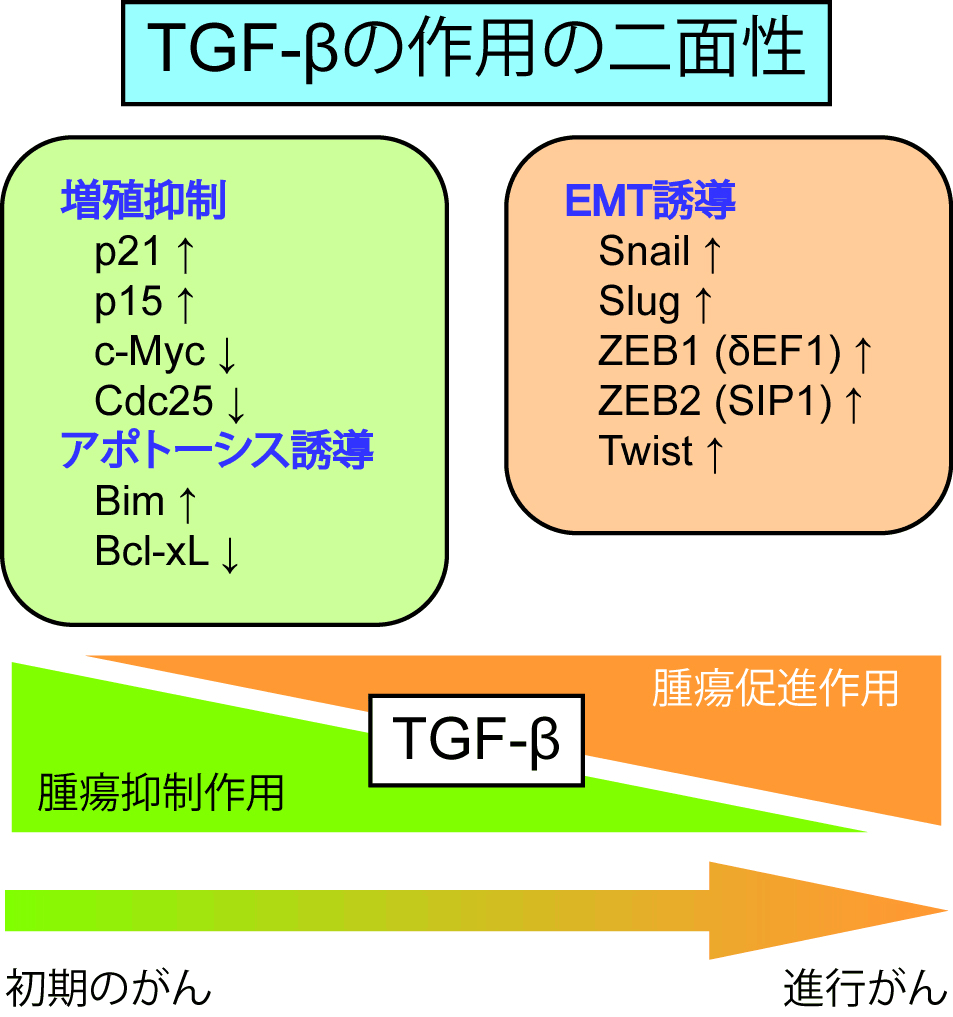
当研究室では、TGF-βが腫瘍抑制作用を失い腫瘍促進因子として作用するように変化する分子機構を明らかにし、かつTGF-βが持つ多彩な腫瘍促進作用を解明することを目指しています。現在まで、TGF-βシグナルを標的としたがんの治療は、TGF-βファミリーのタンパク質やその受容体を主な標的として研究が進められてきました。TGF-βシグナルをより深く理解することは、これらTGF-βシグナル阻害分子をより安全に臨床応用する上で重要です。また、EMTはがんの浸潤・転移に密接に関わっており、その分子機構は今後も研究が必要です。EMT制御分子を明らかにすることで、新たながんの診断・治療法の開発につながることが期待されます。
研究遂行にあたっては、分子生物学、細胞生物学、免疫組織学などの手法や実験動物モデルを用いていますが、最近目覚ましい勢いで進歩してきた次世代DNAシーケンス技術も駆使しています。
(1) TGF-β-Smadのダイナミックな転写調節機構の解明
TGF-β-Smadのダイナミックな転写調節機構の解明では、クロマチンのダイナミックな変化に伴うSmad結合パターンの変動、がん遺伝子・がん抑制遺伝子によるSmadの結合パターンの変化とこれに関与する遺伝子を同定し、その作用を明らかにする。
- Harada M, Morikawa M, Ozawa T, Kobayashi M, Tamura Y, Takahashi K, Tanabe M, Tada K, Seto Y, Miyazono K, Koinuma D. (2019). Palbociclib enhances activin-SMAD-induced cytostasis in estrogen receptor-positive breast cancer. Cancer Sci. 110(1):209-220.
- Arase M, Tamura Y, Kawasaki N, Isogaya K, Nakaki R, Mizutani A, Tsutsumi S, Aburatani H, Miyazono K, Koinuma D. (2017). Dynamics of chromatin accessibility during TGF-β-induced EMT of Ras-transformed mammary gland epithelial cells. Sci Rep. 7, 1166.
- Murai F, Koinuma D, Shinozaki-Ushiku A, Fukayama M, Miyaozono K, Ehata S. (2015). EZH2 promotes progression of small cell lung cancer by suppressing the TGF-β-Smad-ASCL1 pathway. Cell Discovery. 1, 15026.
- Isogaya K, Koinuma D, Tsutsumi S, Saito RA, Miyazawa K, Aburatani H, Miyazono K. (2014). A Smad3 and TTF-1/NKX2-1 complex regulates Smad4-independent gene expression. Cell Res. 24, 994-1008.
- Mizutani A, Koinuma D, Tsutsumi S, Kamimura N, Morikawa M, Suzuki HI, Imamura T, Miyazono K, Aburatani H. (2011). Cell type-specific target selection by combinatorial binding of Smad2/3 proteins and hepatocyte nuclear factor 4α in HepG2 cells. J Biol Chem. 286, 29848-60.
(2) TGF-βによる上皮間葉転換(EMT)の調節機構と多彩な表現型の解析
TGF-βによるEMTの調節機構と多彩な表現型の解析では、転写因子ZEB1(δEF1)とSmad2/3のChIP-seqによるEMTの分子機構の研究、スプライシング制御因子ESRPによるEMTの調節機構の研究を行う。
- Katsura A, Tamura Y, Hokari S, Harada M, Morikawa M, Sakurai T, Takahashi K, Mizutani A, Nishida J, Yokoyama Y, Morishita Y, Murakami T, Ehata S, Miyazono K, Koinuma D. (2017). ZEB1-regulated inflammatory phenotype in breast cancer cells. Mol Oncol. 11(9):1241-1262.
- Mizutani A, Koinuma D, Seimiya H, Miyazono K. (2016). The Arkadia-ESRP2 axis suppresses tumor progression: analyses in clear-cell renal cell carcinoma. Oncogene. 35, 3514-23.
- Horiguchi K, Sakamoto K, Koinuma D, Semba K, Inoue A, Inoue S, Fujii H, Yamaguchi A, Miyazawa K, Miyazono K, Saitoh M. (2012). TGF-β drives epithelial-mesenchymal transition through δEF1-mediated downregulation of ESRP. Oncogene. 31, 3190-201.
- Shirakihara T, Horiguchi K, Miyazawa K, Ehata S, Shibata T, Morita I, Miyazono K, Saitoh M. (2011). TGF-β regulates isoform switching of FGF receptors and epithelial-mesenchymal transition. EMBO J. 30, 783-95.
(3) がんの浸潤・転移を促進するTGF-βの多彩な作用の解明
がんの浸潤・転移を促進するTGF-βの多彩な作用の解明では、RNA結合タンパクやmTORシグナル調節分子などを中心に新規分子の機能を研究し、がん幹細胞への影響や、がんの浸潤・転移との関連を明らかにする。
- Nishida J, Miyazono K, Ehata S. (2018). Decreased TGFBR3/betaglycan expression enhances the metastatic abilities of renal cell carcinoma cells through TGF-β-dependent and -independent mechanisms. Oncogene. 37(16):2197-2212.
- Kawasaki N, Isogaya K, Dan S, Yamori T, Takano H, Yao R, Morishita Y, Taguchi L, Morikawa M, Heldin CH, Noda T, Ehata S, Miyazono K, Koinuma D. (2018). TUFT1 interacts with RABGAP1 and regulates mTORC1 signaling. Cell Discov. 9;4:1.
- Sakurai T, Isogaya K, Sakai S, Morikawa M, Morishita Y, Ehata S, Miyazono K, Koinuma D. (2016). RNA-binding motif protein 47 inhibits Nrf2 activity to suppress tumor growth in lung adenocarcinoma. Oncogene. 35, 5000-9.
- Hoshino Y, Nishida J, Katsuno Y, Koinuma D, Aoki T, Kokudo N, Miyazono K, Ehata S. (2015). Smad4 Decreases the Population of Pancreatic Cancer-Initiating Cells through Transcriptional Repression of ALDH1A1. Am J Pathol. 185, 1457-70.
- Katsuno Y, Ehata S, Yashiro M, Yanagihara K, Hirakawa K, Miyazono K. (2012). Coordinated expression of REG4 and aldehyde dehydrogenase 1 regulating tumourigenic capacity of diffuse-type gastric carcinoma-initiating cells is inhibited by TGF-β. J Pathol. 228, 391-404.
- Ehata S, Johansson E, Katayama R, Koike S, Watanabe A, Hoshino Y, Katsuno Y, Komuro A, Koinuma D, Kano MR, Yashiro M, Hirakawa K, Aburatani H, Fujita N, Miyazono K. (2011). Transforming growth factor-β decreases the cancer-initiating cell population within diffuse-type gastric carcinoma cells. Oncogene. 30, 1693-705.
