細胞内シグナリングをどう攻めるか
宮園 浩平 (「続ロマンチックな科学者」より)
スウェーデンのルードヴィヒ癌研究所にて
私は8年にわたってスウェーデンのウプサラ大学にあるルードヴィヒ癌研究所で増殖因子の研究を行った。なぜ、スウェーデンにそんなに長くいたのかとよく聞かれる。これは日本人よりも欧米の研究者からよく聞かれる質問である。実際スウェーデンは冬は日が短く、朝10時近くにならないと太陽が昇らないし、3時を過ぎると真っ暗になってしまう、また、どんよりと曇っている日も多く、太陽のありがたさを実感する毎日である。曇りの日が多いのはイギリスなどにも共通した悩みであろうが、これに冬の短さが加わるのであるから、確かに住みやすいところというにはほど遠い。にもかかわらず8年も住んだのは結局のところ、ルードヴィヒ癌研究所での研究の魅力であったのだろう。私はアメリカに留学した経験はないので、アメリカの一流のラボとの違いはあまりよくわからない。とりあえず自分の与えられた環境が思ったよりよかったので、ついつい長居をしてしまったというのが正直なところである。
スウェーデンに行って最初に驚いたことは、隣にいる若者たちがNatureに論文が通ったとか、JBC(Journal of Biological Chemistry)に今度論文が載るとか平気で話していたことである。労働時間を比べると私がいた日本の研究室の半分しか働いていないように見えるし、彼らが自分で一生懸命考えて工夫してやっているとはあまり思えない。そんな人たちから突然ネイチャーだのJBCだのと言われて、自分たちは何をあくせく頑張っていたのだろうと一時は真剣に悩んだものである。しかし、今から思えば当時すでに完全にシステムができあがり、後はそれを自由に駆使すればよいだけのスウェーデンのラボの持つ強みだったのではないかと私なりに解釈している。後に述べるように当時のウプサラ大学の研究室ではPDGF(platelet-derived growth factor)を血小板から純化するシステムを持っており、その操作そのものは1ヶ月近くかかる重労働であるが、遺伝子組換え操作が十分でなかった時代に、きわめて貴重なPDGFが常にある程度の量得られていた。当時、PDGFを純化できるラボは数えるほどしかなかったので、得られるデータは常にトップレベルにあったわけである。きちんとしたシステムをつくりあげるというのはスウェーデン人のもっとも得意とするところであり、このことがたった900万人たらずの人口にもかかわらず、スウェーデンが優れた研究を行えている理由ではないかと考えている。
増殖因子と増殖抑制因子
1985年ころにスウェーデンで私のボスであるカール・ヘンリク・ヘルディン博士が、客が来ると必ず描いていた絵が次のページの図である。彼はCalle(カーレ)という愛称で呼ばれていたが、「またカーレがあの図を描いてる」と横目で見て笑っていたものである。カーレは大学院時代にPDGFの研究を始め、ひたすらにPDGFを純化しその構造を決定することをテーマとして研究を続けていたそうである。当時はPDGFはEGF(epidermal growth factor)に続いて見つかった新しい増殖因子で、血小板が豊富にあることから動脈硬化の進展に関わっているのではないかと期待された分子である。ところがPDGFを純化してその構造を決定したところ、癌遺伝子の一つであるsisときわめてよく似ていることが明らかとなった。また平行して研究を行っていたPDGFレセプターがチロシンキナーゼ活性を持つことも明らかとなった。当時はちょうどsrcをはじめ、多くの癌遺伝子の存在が確認され、そのうちのいくつかがチロシンキナーゼであることがあきらかとなり、にわかに細胞の増殖促進機構と癌遺伝子との関係が注目されるようになったころである。カーレの図は、正常の細胞ではPDGFをはじめとする増殖因子がレセプターに結合すると細胞内にシグナルが伝わり細胞が増殖する。癌細胞では増殖因子が過剰につくられたり(1)、レセプターや細胞内のシグナル伝達分子に異常が起こって信号が常にオンになったりしているために(2-3)、細胞の自律性の増殖が起こるというものである。つまり癌遺伝子というのは決して外から持ち込まれた異物ではなく、正常の細胞に存在する増殖促進機構に異常が起こったものである、ということであった。だからこれからは細胞内シグナル伝達に精力的に取り組みたい、というのが来客への説明だったわけである。
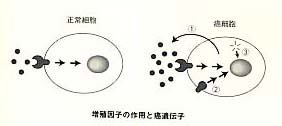
アクセルとブレーキ
1986年になってカーレが私のところにやってきて、前述の図のmodified versionを私に示してきた(下図参照)。それは何の変哲もない図であるが、要するに細胞の増殖には正と負のシグナルがあって、負のシグナルがこれから大事になるだろうから何かこれに関係したことをやってくれないか、ということであった。すでに増殖抑制と癌抑制遺伝子との関係はいろんなところで言われていたのでさほど目新しいこととはいえないが、私も何か新しいことを始めたかったのですぐにこれに飛びついたのである。今から考えると非常に先見の明があると思うのは、カーレがこの図を説明にするにあたって増殖抑制因子のシグナルは増殖因子とは独立して核まで届くように描いていることである。当時から増殖抑制因子の信号がどのようにして交わるかというのはしきりと議論されたことで、増殖因子のレセプターが増殖抑制因子の信号で活性化されなくなるのではないかなど、いろいろなことが議論されていた。そのころ漠然と増殖抑制因子の信号は独立して核まで行くのであろうと考えてカーレはこの図を描いたのかもしれないが、現在のTGF-βの研究の結果を見ると彼の考えは結構正しかったと言える。
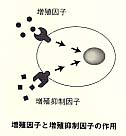
今、私はこの図を使って、「細胞の増殖には自動車のようにアクセルとブレーキがあって、われわれはブレーキの研究をやっているのである」と話すことにしている。癌抑制遺伝子の異常は、要するにブレーキが壊れた状態なのであるというとわかりやすいのではないかというのが私の浅はかな考えである。
TGF-βレセプターのクローニング
われわれが増殖抑制因子の研究を行うにあたって選んだ因子はTGF-β(transforming growth factor-bate)であった。当時すでにTGF-β以外にも細胞の増殖を抑制する因子はいくつもあったはずなので、なぜTGF-βをやることに決めたかはあまり覚えていない。TGF-βは最初は増殖因子の一つとして発見され、後で増殖抑制因子であることがわかったという珍しい経緯を持つ因子である。おそらくは学会などでもよく話を耳するということから、われわれに最も身近な因子としてTGF-βの研究を始めたのではないかと思う。最初はまずTGF-βが潜在型でつくられることから、潜在型TGF-βの構造を明らかにした。この仕事が一段落つきはじた1990年ころになって、TGF-βのレセプターの研究をはじめようということになった。この時、スウェーデンに一條秀憲博士(現・東京大学薬学部教授)と遅れてピーター・テンダイケ博士、山下英俊博士(現・山形大学教授)が加わった。ピーターはすでにアメリカでTGF-β3のクローニングを行ったことで知られた研究者であり、われわれとしてはこの上ない味方が加わった気持ちであった。
1992年にはTGF-βの世界はレセプターがなかなかクローニングされずに停滞していた時期から、アクチビンやTGF-βのII型レセプターがクローニングされ新たな展開を迎えつつあった。増殖因子のレセプターがチロシンキナーゼ型レセプターであるのに対し、II型レセプターはセリンスレオニンキナーゼ型レセプターであることがわかり、ではもう一つのシグナル伝達レセプターであるI型レセプターはどんな構造を持っているかということが注目されていた。またTGF-βには類似した物質が数多くあり、骨形成因子(BMP; bone morphogenetic protein)やアクチビンがTGF-βスーパーファミリーとして分類され、平行して研究が行われるようになっていた。
我々はとりあえずII型レセプターに類似したものをいくつかクローニングしようということで手分けして実験をはじめ、いくつかのクローンを得た。そのときには3つも取れば十分であろうと考えていたのだが、ピーターはなかなかやめてくれず、結局は6つクローニングしてやっと(一旦)ストップするということになった。しかし今から考えると、我々がクローニングを行っている途中から何となくI型レセプターもセリンスレオニンキナーゼ型レセプターかもしれないとおぼろげに考えるようになっており、実際にTGF-βのI型レセプターは5番目にクローニングしたレセプターであったわけであるから、ピーターが重戦車のようになってクローニングし続けた苦労は決して無駄ではなかったことになる。カーレや私は百科事典を作るわけではないので、3つくらいクローニングして先へ進みたいと考えていたのであるが、後から考えてみるといっぱいレセプターをクローニングしたからこそ初めて分かったことも少なくない。TGF-βの研究について考えてみると、ファミリーであるアクチビンやBMPの研究を通して学んだこともかなり多く、私は常に研究は横に広がりすぎないようにと考えているのであるが、実際には横に広がってこそ初めてわかることもあるのだということをこの時実感したものである。
シグナルのクロストーク
1995年に日本に帰国してしばらくして、ショウジョウバエや線虫の研究からSmadという一群の分子がTGF-βのシグナル伝達の重要なコンポーネントであることが報告された。われわれはいろいろな手法を使ってTGF-βのシグナル分子を探していたので、思わぬところから仕事が進んでいったという感はぬぐえなかった。そしてあっという間にSmadがレセプターによって活性化されると核へ移行して転写を調節するということが示された。一方で、Smadのシグナル伝達機構が明らかとなったおかげで、それまで培養細胞でいろいろと議論していたことが、分子レベルでかなり明確になった。とくに他のシグナルとのクロストークはSmadがいろいろな分子と相互作用することによって起こっているのではないかということが明らかとなったことは重要である。加藤茂明教授(東大分子生物学研究所)がビタミンDレセプターとSmadが結合することを明らかにされ、それまで山のようにあったビタミンDとTGF-βの関係について分子レベルで決着を付けることができた。また田賀哲也教授(熊本大学)がサイトカインのシグナル分子STATとSmadの相互作用を明らかにしてくださり、サイトカインのシグナルとTGF-βシグナルの関係についても突破口ができたと言える。そのほかにも癌遺伝子RasとSmadの関連やインターフェロンγとSmadの関係などが次々と報告され、シグナルのクロストークという概念が確立してきていることを実感している。動物の細胞には常にいろいろな信号が与えられているわけであるから、それらのシグナルの相互作用というのは生体にとってきわめて重要であることは言うまでもないことである。シグナル伝達機構があまりにも複雑になっているという感は否めないが、生体の代謝全体を考えればこれも仕方がないことかもしれない。
発癌のメカニズムとTGF-β
TGF-βは細胞の増殖のブレーキとして働くと述べた。ブレーキが壊れれば細胞は異常に増殖することになるわけである。こうした希望的推測はなかなか現実のものとはならないのであるが、TGF-βの場合には1995年以降こうした事例が2つも報告されている。まずTGF-βのII型レセプターの細胞外ドメインにはアデニンが10個並んだ部位があり、遺伝性非ポリープ性大腸癌では高頻度でこの部分に異常がおこり、アデニンが9個もしくは8個しか読みとられないため、正常なTGF-βのII型レセプターが作られないということが発見された。ここで重要なことは哺乳類ではTGF-βの・型レセプターは1つしかないということである。アクチビンやBMPに比較するとTGF-βのII型レセプターが1種類しか存在しないという事実の持つ意味は大きい。またアデニンが10個並んだ部位は他のレセプターに見られないというだけでなく、マウスのTGF-βのII型レセプターにも見られない特徴である。つまりヒトだけがTGF-βのII型レセプターに異常が起こりやすいという可能性を示唆しているのである。
もう一つはシグナル分子であるSmad4の異常である。Smad4は膵臓癌の癌抑制遺伝子がヒト染色体では18番長腕にあるということからクローニングされ、最初はDPC4(deleted in pancreatic carcinoma, locus 4)と名付けられ、クローニングされて初めてTGF-βのシグナルに関与することが分かった分子である。Smad4の異常は膵臓癌だけでなく大腸癌などでも見つかっている。またSmad4もヒトでは類似した分子が1種類しか見つかっていないことも興味深い事実である。
私自身はTGF-βのシグナル伝達を研究することを通してさまざまな生命現象を見たいというのが望みであるが、多くの事象が細胞の癌化に密接に結びついているのは幸いなことである。TGF-βはカエルには存在するがショウジョウバエなどの無脊椎動物では見つかっておらず、進化の段階では比較的最近になって加わった分子であると言える。BMPやアクチビンにも細胞の増殖抑制作用はあるが、TGF-βに比べるとはるかに弱い。こう考えると、進化にともなってTGF-βという増殖抑制因子が生体に備わったものの、そのシグナルが壊れた際の安全装置についてはまだまだ進化の途上なのかもしれない。
