TGF-βとSmadによるシグナル伝達機構:過去・現在・未来
宮園 浩平
- PART-1 これまでの研究の歩み「増殖因子と増殖抑制因子」
- PART-2 現在のトピックス「TGF-βスーパーファミリーのシグナル伝達とSmad」
- PART-3 展望「シグナル伝達ネットワーク」
PART-2 現在 「TGF-βスーパーファミリーのシグナル伝達とSmad」
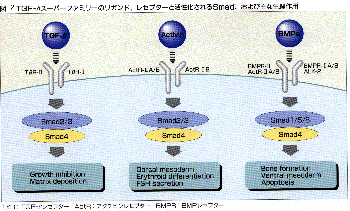
TGF-βスーパーファミリーにはTGF-βの他、アクチビン、BMPなどが含まれる。これらの因子は細胞の増殖や、分化、アポトーシスの制御などに重要な役割を果たしている。TGF-βは多くの細胞の増殖を抑制するほか細胞外マトリックスの産生などに関与している。BMPは元来は骨や軟骨の形成を促進する因子として見つかったが、BMP様の因子は無脊椎動物にも存在し、腹側の中胚葉の誘導など形態形成に重要な役割を持っていることから、現在では発生学の分野では欠かせない因子となっている。アクチビンは下垂体からの卵胞刺激ホルモンの分泌を促進する分子として見つかったが、赤芽球の分化促進や発生のさいの背側の中胚葉の誘導など、やはり多彩な作用をもったサイトカインとして知られるようになった。
TGF-βスーパーファミリーの蛋白質は2種類のセリン・スレオニンキナーゼ型レセプター(I型とII型)に結合する。II型レセプターはリガンドと結合していない状態で活性化されているが、リガンドが結合してII型レセプターとI型レセプターが複合体を作るとII型レセプターがI型レセプターを活性化して細胞内にシグナルを伝達する。TGF-βスーパーファミリーにはTGF-β、アクチビン、BMPに特異的なレセプターもあるが、一方でこれらの因子に一部共有されるレセプターもある(図2)。しかしTGF-βの場合には多くの細胞で1種類のI型レセプターと1種類のII型レセプターだけが存在し、他のリガンドとはレセプターを共有していないのが特徴である。ただしALK-1と呼ばれるI型レセプターは現在は孤児レセプターとして分類されているが、血管内皮細胞に特異的な第2のTGF-β I型レセプターである可能性が示唆されている。
Smadの発見と3つのサブタイプ
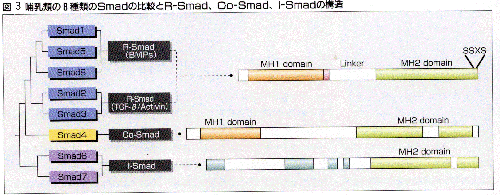
Dpp(decapentaplegic)はショウジョウバエのBMPのホモローグである。Dppのシグナルを修飾する遺伝子のスクリーニングの結果、Mad(Mothers against Dpp)が得られた。一方、DAF-4は線虫のBMP様因子のII型レセプターであるが、sma-2、sma-3、sma-4はその異常がdaf-4遺伝子の異常と同じ様な表現型を示す遺伝子として得られた。これらのSma蛋白質とMadはアミノ酸配列で高い相同性を示し、いずれもTGF-βスーパーファミリーの因子のシグナルを伝えることから、これらをSma+Mad = Smadと呼ぶようになった。こうした下等動物での発見をきっかけにSmadファミリーの分子が次々にクローニングされ、この分野の研究は新しい展開を迎えた。哺乳類ではこれまで8種類のSmadが報告されており、Smad1-8と名付けられている。
我々はSmad6やSmad7がクローニングされたのをきっかけに、Smadはその構造と機能から3種類に分けることができることを1997年に提唱した。すなわち、I型レセプターによって活性化されて、TGF-β(およびアクチビン)とBMPのそれぞれの経路で特異的なシグナルを伝えるR-Smad(receptor-regulated Smad)、すべての経路で共通に用いられR-Smadと複合体を作るCo-Smad(common-mediator Smad)、さらにこれらのシグナルを伝達するSmadに抑制的に作用するinhibitory Smad(I-Smad)である(図3)。R-SmadはTGF-βやアクチビンで活性化されるSmad2とSmad3、BMPで活性化されるSmad1、5、8の二つのグループにさらに分けることができる。Co-Smadはこれまで哺乳類ではSmad4しか知られていない。I-SmadにはSmad6とSmad7の2つがある。
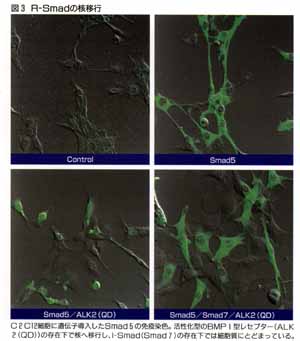
R-SmadはI型レセプターでリン酸化されて活性化されるとCo-Smadとヘテロ多量体を作り、核の中へ移行する(図4)。核では他の転写因子と複合体を作ったり、Smad自身が直接DNAへ結合することによって標的遺伝子の転写を調節する。一方I-SmadはR-Smadの核への移行を抑制するのである。
R-SmadはN末端側とC末端側にSmad間で高く保存された領域を持っており、これらはそれぞれMH(Mad homology)1ドメイン、MH2ドメインと呼ばれている。MH1とMH2の間はリンカーとよばれる領域でつながれているが、リンカーの長さやアミノ酸配列はまちまちである。R-Smadの最もC末端側にはSer-Ser-X-Serというアミノ酸配列(SSXSモチーフ)があり、このうちC末端に近い2つのSerがI型レセプターによってリン酸化を受ける。Co-SmadはMH1とMH2を持っているが、SSXSモチーフは持っていない。I-SmadはMH2を持っているだけでMH1のアミノ酸配列はあまり保存されておらず、SSXSモチーフも持たないのが特徴である(図3)。
Smadの活性化
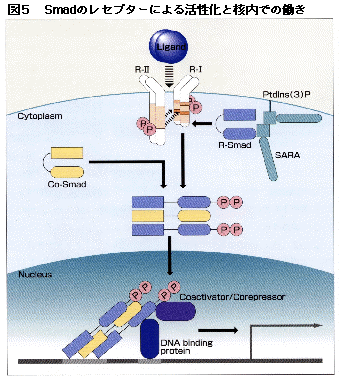
II型レセプターがI型レセプターを活性化するとR-SmadがI型レセプターに結合し、SSXSモチーフがリン酸化される。R-Smadは未刺激の状態ではMH1とMH2が互いに結合して折れ畳んだような状態にあるが、活性化されると両者の結合がなくなる(図5)。I型レセプターとR-Smadの結合は一過性で、R-Smadはリン酸化されるとすぐにI型レセプターから遊離する。ところでR-Smadは決して細胞質内で遊離した状態にあるわけではなく、たとえばSmad2やSmad3の場合は細胞膜に結合する蛋白質であるSARAと結合した状態で存在する。このためSmad2/3は活性化されたTGF-βレセプターに効率よく結合して活性化を受け、SARAから離れてCo-Smadと複合体を作り、核へと移行していくのである。SARAがないとSmad2/3は細胞質内に漂っているような状態となり、活性化されたレセプターに効率よく遭遇できないのではないかと予想される。
R-Smadがリン酸化されるとCo-Smadとヘテロ多量体が作られる。より安定的な複合体の構造をもち高い活性を発揮するためにはCo-Smadの存在がきわめて重要である。Smadは単量体として細胞内に存在し、I型レセプターによって活性化されてはじめて多量体となる。Smad4のMH2ドメインの結晶構造の解析からSmadは3量体を作るものと考えられており、このことからレセプターに活性化されるとR-SmadとCo-Smadが2分子と1分子からなるヘテロ3量体を作ってシグナルを伝えるものと考えている。
Smadはプロテアソームで分解される。ある種のSmadのリンカー部分にはPPXYというアミノ酸配列(PYモチーフ)があり、WWドメインを持った蛋白質と結合する。Smad1やSmad5はSmurf1というWWドメインとHECTドメインを持った蛋白質と結合する。Smurf1はSmad1/5のユビキチン化を促しプロテアソームでの蛋白質分解を促進することから、細胞内でのSmad1/5の量を調節する作用を持っていると考えられている。Smuf1によるSmadの分解はリガンド刺激なしでおこるが、リガンド刺激によって分解を促進するような系が存在するかどうかについては明らかとなっていない。
Smadの核内での作用

レセプターによって活性化されたSmadは核内に移行した後、標的となるざまざまな遺伝子の転写因子として作用する。Smadの核の中での作用は3つにわけて考えるとわかりやすい。つまり、(1)Smad自身のDNAへの直接の結合、(2)他の転写因子との結合、(3)転写のコアクチベーターやコレプレッサーとの結合である(図5および表1)。
転写の活性化領域はMH2ドメインにありMH1はこれを負に調節している。しかしSmadのDNAへの直接の結合はMH1領域を介しておこる。Smad3やSmad4は"GTCT"またはこれに相補的な"AGAC"という塩基配列に結合する。こうした配列はTGF-βに反応する遺伝子であるPAI-1(plasminogen activator inhibitor-1)やJunB、免疫グロブリンのクラススイッチに関係したIgCαなどのプロモーター領域に見られ、Smad3/4による転写調節に密接に関係している。
Smad2はSmad3と同様、TGF-βやアクチビンによって活性化されるR-Smadで、両者は互いによく似ているが、Smad2はDNAに結合しない。これはMH1領域にSmad2に特異的に見られるエクソン3によってコードされる30アミノ酸からなる領域がDNAへの結合を阻害しているためである。このためSmad2のPAI-1の転写活性作用はSmad3より弱い。このことはある標的遺伝子にはSmadのDNAへの結合がきわめて重要であることを示しているが、同時にSmad2でもPAI-1の転写活性作用はある程度見られることから、SmadのDNAへの結合はその転写活性作用には必ずしも不可欠ではないことを物語っている。実際にDNAへの直接の結合が強く見られるのはSmad3とSmad4のみであり、他のSmadはショウジョウバエのSmad2/3様因子であるdSmad2も含めてほとんどDNAへ結合しないか、しても弱いものである。こう考えるとSmad3のDNAへの結合の方がむしろ例外的で、後に述べるようにTGF-βが進化の比較的新しい時期に出現したのと同様に、DNAへ直接結合するSmad3も比較的新しく出現したものなのかもしれない。
ショウジョウバエのMadは"GCCGnCGC"という塩基配列(GCCGモチーフ)と結合する。最近、我々のグループの川畑らの研究でBMPに活性化されるR-Smad(Smad1やSmad5)もGCCGモチーフに結合して転写を活性化することが明らかとなり、このことからTGF-βとBMPの標的遺伝子の相違が遺伝子のプローモーターの詳細な解析で明らかになることが期待されている。
Smadと他の転写因子との結合
Smadは直接DNAに結合するだけでなく、さまざまな転写因子と結合して間接的に特異的なDNA配列に結合する。Mix.2遺伝子はカエルの初期発生に関与し、アクチビンによって誘導される遺伝子であるが、Mix.2プロモーターにはFAST-1とよばれる転写因子がSmad2やSmad4と複合体を作って結合することが明らかとなった。FAST-1とSmad2の結合はSmad2ではMH2領域を介して起こる。Smad3もFAST-1と結合するがBMPで活性化されるR-SmadはFAST-1とは結合しない。哺乳類でもFAST-1の相同分子がクローニングされている。これらのFASTファミリーの転写因子とSmadはそれぞれが特異的な塩基配列に結合し、協調して標的遺伝子の転写を調節している。SmadのDNAに対する結合の親和性は必ずしも高くなく、FASTと協調することによって高い親和性が得られているのかもしれない(図6A)。
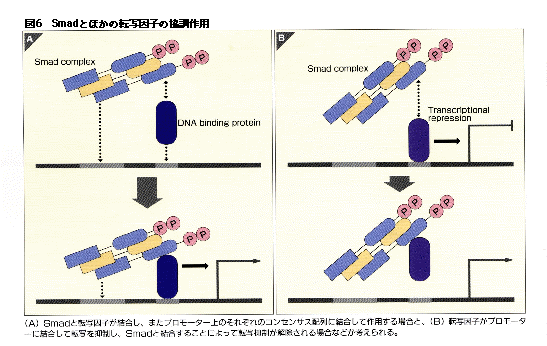
(A) Smadと転写因子が結合し、またプロモーター上のそれぞれのコンセンサス配列に結合して作用する場合と、(B) 転写因子がプロモーターに結合して転写を抑制し、Smadと結合することによって転写抑制が解除される場合などが考えられる。
これ以外にもさまざまな転写因子がSmadと結合し、協調あるいは拮抗してシグナルを伝える(表1)。我々のグループの花井らは京都大学ウイルス研の伊藤嘉明教授らとの共同研究で、Smadと転写因子PEBP2の協調作用を明らかにした。PEBP2はCBFとも呼ばれ、αとβの二つのサブユニットからなる。αサブユニットにはαA、αB、αCの3種類があるが、αBはAML1とも呼ばれ、M2などのある種の白血病でしばしば異常が見られる。またαAのノックアウトマウスでは骨ができないなど、その作用はTGF-βやBMPの作用との関連を伺わせる。3種類のαサブユニットはすべてのR-Smad(Smad1、2、3、5)と結合し、R-Smad、Co-Smad、PEBP2αの3者による複合体が検出された。イムノグロブリンのクラススイッチに関わるIgCαのプロモーターのTGF-β反応領域にはSmad3/4とPEBP2の結合配列があり、両者が複合体を形成してこの領域に結合する。さらにこのプロモーターに対してR-SmadとPEBP2αが協調的に転写を活性化することが確認された。PEBP2αB(AML1)はマウスの骨髄性白血病に関連した遺伝子であるEvi-1とキメラタンパク質を作るが、Evi-1もSmad3と結合してTGF-βのシグナルを調節する点はたいへん興味深い。
このようにSmadと結合して転写活性化に協調して働く転写因子のほか、SIP1などのようにTGF-βなどのリガンドの刺激のない状態で標的遺伝子のプロモーターに結合して転写を抑制し、活性化されたSmadと結合するとプロモーターから離れて転写が活性化されるような因子も存在することが報告されている(図6B)。
Smadと転写のコアクチベーター、コレプレッサーとの結合
転写のコアクチベーターであるp300やCBP(CREB binding protein)はSmad2やSmad3と結合し、転写の活性化に関与している。p300/CBPはヒストンアセチルトランスフェラーゼ(HAT)活性をもっており、ヒストンをアセチル化することでクロマチン構造をほぐし、転写を活性化させる(図7A)。Smad内でのp300結合領域は転写活性化能を有するMH2領域であり、一方p300のSmad3との結合領域はC末端に近い部分である。p300はさまざまな転写因子と結合することから核内でp300が他の転写因子との橋渡しをすることで異なったシグナルを調節することが示唆されてきたが、最近SmadとSTATの間でそのような協調作用が確認された(展望の項参照)。
さらに我々のグループの川畑、井上らは癌原遺伝子産物であるc-SkiがTGF-βシグナルを伝えるSmad2/3やSmad4と結合することを明らかにした。c-SkiはTGF-βの転写活性を抑制する。コアクチベーターであるp300はTGF-βシグナルに協調的に働くのに対し、c-SkiはSmad3へのp300の結合を阻害し、その転写活性化作用も抑えた。Smadと複合体を形成したp300のHAT活性に対するc-Skiの影響を検討したところ、c-Ski存在下でヒストンのアセチル化が抑制された。さらにSmad-c-Ski複合体にmSin3Aを介してヒストン脱アセチル活性を持つHDAC1が結合することが確認され、ヒストンデアセチラーゼ複合体を通じて転写抑制を行なっていることが明らかとなった(図7B)。Smadと結合する転写のコレプレッサーとしてはc-SkiのほかTGIFも知られている。このようにTGF-βシグナルはDNAに結合したSmadがHAT活性を持つコアクチベーターやヒストン脱アセチル活性をもつコレプレッサーをリクルートすることで調節されているわけである。
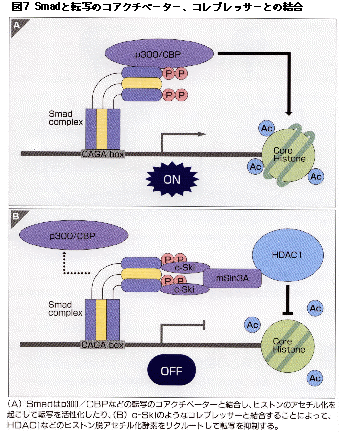
(A) Smadはp300/CBPなどの転写のコアクチベーターと結合してヒストンのアセチル化を起こして転写を活性化したり、(B) c-Skiのようなコレプレッサーと結合することによってHDAC1などのヒストン脱アセチル化酵素をリクルートして転写を抑制する。
抑制型Smadの作用
I-Smadは構造的にはSmadに類似していることからSmadファミリーに属するが、機能的にはSmadのシグナルを抑制する分子である。シグナルを抑制する分子は数多く存在するがI-Smadのようにシグナル分子に類似した構造を持つ抑制分子はユニークである。我々のグループの今村らは1996年当時、新しくクローニングしたSmad6が何をしているかを調べていくうちに、Smad6がR-Smadと同様II型レセプターによって活性化されたI型レセプターに結合するが、R-Smadと異なりSmad6の場合はリン酸化を受けずレセプターに結合したままなかなか離れないことを見いだした。同じようなことは他のグループでSmad7を用いて確認された。そこでI-Smadはレセプターとの結合を競合することによって、R-Smadの活性化を抑制するものと考えられるようになった(図8)。またSmad6はSmad1とSmad4の複合体形成にも競合することが報告されている。Smad7はTGF-β、アクチビン、BMPのシグナルをすべて抑制するのに対し、Smad6はBMPに対する抑制作用が強く、TGF-βやアクチビンの抑制効果は弱い。
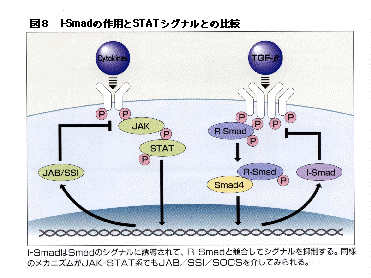
I-SmadはSmadのシグナルに誘導されて、R-Smadと競合してシグナルを抑制する。同様のメカニズムがJAK-STAT系でもJAB/SSI/SOCSを介して見られる。
R-Smadの変異体もI-Smadと同様な働きを持つ。たとえばSmadで高度に保存されたアスパラギン酸(Smad3ではAsp-407)をグルタミン酸に置換すると変異型Smad3はレセプターに安定的に結合し、TGF-βのシグナルを優勢抑制性に抑制するようになる。こうした変異型Smad3の作用はシグナルの経路に特異的でTGF-βの作用は抑制するがBMPのシグナルは抑制しないという特徴がある。
TGF-βは強力な増殖抑制因子であると同時に組織の線維化を起こす。肝臓の線維化、腎臓の硬化、肺線維症などにはTGF-βの産生の上昇が密接に関与していることがよく知られている。我々のグループでは藤井らがSmadをアデノウイルスベクターに組み込んでさまざまな細胞に遺伝子導入しその作用を調べてきた。そこで千葉大学第2内科の中尾篤人博士との共同でブレオマイシンで誘導したラットの肺線維症にアデノウイルスベクターに組み込んだ抑制型Smadを与えたところ、Smad7で肺線維症が抑制できることがで明らかとなり、さまざまな線維化をともなう難病に抑制型Smadが有用である可能性を示唆することができた。
I-Smadのもう一つの特徴はその発現がBMPやTGF-βなどの刺激により増加することである(図8)。つまり、自己の刺激で産生が誘導されてネガティブフィードバックループを作ってシグナルを抑制することになる。こうしたI-Smadの特徴は哺乳類のSmad6やSmad7だけでなくショウジョウバエのI-SmadであるDadにも見られる。このようにシグナルで誘導されて自らのシグナルをレセプターに近いところで抑制する分子はサイトカインのシグナル伝達系にも存在し、JABやSSI、SOCSなどと呼ばれている(図8)。JAB/SSI/SOCSは構造的にはI-Smadとは全く似ていないが、異なったシグナル伝達系でそっくりのメカニズムが存在することは興味深い。
癌とTGF-βシグナル
TGF-βは細胞の増殖のブレーキとして働くと述べた。ブレーキが壊れれば細胞は異常に増殖することになるわけである。TGF-βの場合には1995年以降こうした事例が2つ報告されている。まずTGF-βのII型レセプターの細胞外ドメインにはアデニンが10個並んだ部位があり、DNAの修復機構に異常がある遺伝性非ポリープ性大腸癌(HNPCC)では高頻度でこの部分に異常がおこり、アデニンが9個もしくは8個しか読みとられないため、正常なTGF-βのII型レセプターが作られないことが発見された。ここで重要なことは哺乳類ではTGF-βのII型レセプターは1つしかないということである。アクチビンやBMPと比べるとTGF-βのII型レセプターが1種類しか存在しないという事実の持つ意味は大きい。またアデニンが10個並んだ部位は他のレセプターに見られないというだけでなく、マウスのTGF-βのII型レセプターにも見られない特徴である。実際にマウスでこの部分に異常が起こりやすいかどうかは確認されていないが、ヒトだけがTGF-βのII型レセプターに異常が起こりやすいという可能性を示唆しているのである。
もう一つの例はシグナル分子であるSmad4の異常である。Smad4は膵臓癌の癌抑制遺伝子がヒト染色体では18番長腕にあるということからクローニングされ、最初はDPC4(deleted in pancreatic carcinoma, locus 4)と名付けられ、クローニングされて初めてTGF-βのシグナルに関与することが分かった分子である。Smad4の異常は膵臓癌だけでなく大腸癌や若年性のポリポーシスなどでも高い頻度で見つかっている。Smad4はカエルでは2種類存在するが、哺乳類では類似した分子が1種類しか見つかっていないことも興味深い事実である。もしSmad4がヒトでは1種類しかないとなると、ここはシグナル伝達経路の1本道となるわけで、Smad4の異常と癌の関わりの重要性はさらに高くなると言ってよいだろう。
Smad4と家族性大腸癌の癌抑制遺伝子であるAPC遺伝子のノックアウトマウスを掛け合わせて局所での両遺伝子の発現を喪失させると、浸潤性の高い大腸癌ができることが東大の武藤誠教授らの研究で明らかとなり、マウスでもSmad4が癌の悪性化に密接に関わっていることが示された。我々のグループの加藤はin vitroの3次元培養の系で変異型Smad3を発現したヒト角化細胞は、その発現量に相関してTGF-βの増殖抑制活性に対する反応性が低下するだけでなく、コラーゲンマトリックスの中に浸潤していくことを見い出し、TGF-βシグナルの遮断が癌の転移に関わっている可能性を示すよいモデルをin vitroで明らかにした。
TGF-βのII型レセプターやSmad4以外にもいくつかのTGF-βシグナル分子の異常が癌と関係しており、これを図9にまとめた。TGF-βはカエルには存在するがショウジョウバエなどの無脊椎動物では見つかっておらず、進化の段階では比較的最近になって加わった分子であると言える。BMPやアクチビンにも細胞の増殖抑制作用はあるが、TGF-βに比べるとはるかに弱い。こう考えると、進化にともなってTGF-βという増殖抑制因子が生体に備わったものの、そのシグナルが壊れたさいの安全装置についてはまだまだ不十分だということかもしれない。
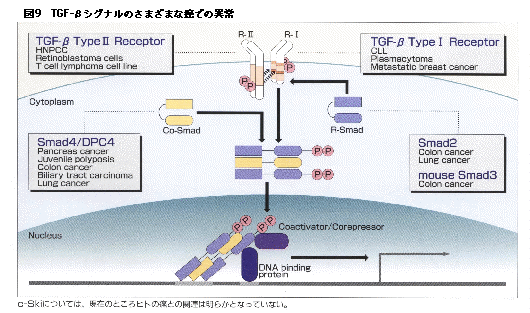
c-Skiについては現在のところ癌化との関連は明らかとなっていない。
