TGF-βとSmadによるシグナル伝達機構:過去・現在・未来
宮園 浩平
- PART-1 これまでの研究の歩み「増殖因子と増殖抑制因子」
- PART-2 現在のトピックス「TGF-βスーパーファミリーのシグナル伝達とSmad」
- PART-3 展望「シグナル伝達ネットワーク」
PART-3 展望「シグナル伝達ネットワーク」
シグナル伝達経路ではシグナルのネットワークやクロストークという言葉がよく使われる。SmadシグナルもRas-MAPキナーゼ経路やビタミンDレセプターのシグナルとクロストークすることが知られている。Rasは代表的な癌遺伝子であるが活性化されたRasはMAPキナーゼによってSmad1やSmad2、Smad3のリンカー部分をリン酸化し、Smadの核への移行を抑制する結果、細胞はTGF-βやBMPの作用に抵抗性になることから、ここにも癌遺伝子とTGF-βシグナルの関わりが存在するわけである。ここでは最後に最近明らかとなったSmadとサイトカインのシグナルのクロストークに焦点をしぼって、(2000年春の段階での)今後の研究の展望について述べてみたい。
STATとSmadのクロストーク
サイトカインレセプターが活性化されるとチロシンキナーゼであるJAKが活性化され、STATの活性化がおこる。STATはオリゴマーを形成したあと核内へ移行して転写因子として働くことから、Smadの作用のメカニズムと極似していると言えよう(図8参照)。STATシグナルとSmadシグナルにはいくつかの形のクロストークが存在するようである。多くの細胞はインターフェロンγ(IFN-γ)で前処理するとTGF-βの作用に抵抗性になる。IFN-γはSTAT1を活性化するが、その結果抑制型SmadであるSmad7の産生が増加し、TGF-βの作用が遮断されるのである(図10A)。
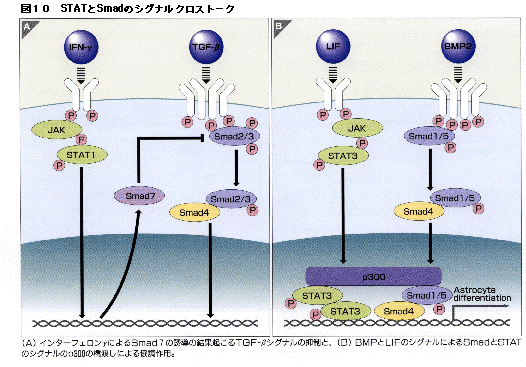
(A) インターフェロンγによるSmad7の誘導の結果起こるTG-βシグナルの抑制と、(B)BMPとLIFのシグナルによるSmadとSTATのシグナルのp300による橋渡しによる協調作用。
一方、STATとSmadの間には協調作用も存在する。Smadが転写のコアクチベーターp300と結合することはすでに述べたが、STATもp300と結合する。神経上皮細胞にLIFとBMPを同時に投与すると星状細胞への分化が顕著に起こる。LIFはSTAT3を、BMPはSmad1(またはSmad5)を活性化するが、両者には直接の結合は見られない。しかし東京医科歯科大学難治研の田賀哲也教授らの研究で、核内でp300がSTAT3とSmad1の橋渡しをして三者の複合体が作られることによってシグナルの協調作用が起こることが明らかになった(図10B)。
このように細胞の種類とシグナルの種類によってSTATとSmadのシグナルが協調的にも拮抗的にも作用しうるわけである。細胞は生体内ではさまざまな刺激を同時に受けているわけであるから、シグナルのネットワークの解明は生体内での細胞の運命を明らかにするるうえで今後もきわめて重要となっていくであろう。
我々はTGF-βのシグナル伝達を研究することを通してさまざまな生命現象を見たいというのが望みであるが、多くの事象が細胞の癌化などいくつかの疾患の病因に結びついていたのは研究を進めていくうえで幸いなことであった。こうした分子レベルでの研究は大いに進展したが、残念ながらTGF-βの研究が病気の治療に直接役立つまでには至っていない。しかしアデノウイルスベクターに組み込んだSmad7の肺線維症に関するデータはSmadの臨床応用の可能性を示していると考えられ、今後さらに研究を進めていきたいと考えている。

